Spis treści:
1. Wstęp
2. Pytania i odpowiedzi
3. Metody leczenia
4.Wnioski
W naszej placówce w celu leczenia uszkodzeń chrząstki stawu kolanowego stosujemy m.in. zaawansowane procedury operacyjne z wykorzystaniem komórek macierzystych.
Komórki macierzyste to nowa alternatywa, służąca leczeniu wielu trudnych schorzeń. Najświeższe badania medyczne skupiają się na nowatorskich metodach mających na celu wytworzenie nowej zdrowej tkanki chrzęstnej przez organizm. Metody te noszą nazwę inżynierii komórkowej i tkankowej, obejmują ona manipulację komórkami, konstruowanie odpowiednich rusztowań tkankowych, wpływanie na czynniki wzrostu tkanek.
Czynniki wzrostu, które stymulują wzrost tkanki mogą zostać wyizolowane i wykorzystane do pobudzenia wytwarzania nowej chrząstki.
Zastosowanie mezenchymalnych komórek macierzystych również jest obiektem wielu najnowszych badań. Mezenchymalne komórki macierzyste to pierwotne komórki, które otrzymuje się z żywej ludzkiej tkanki, takiej jak szpik kostny. Kiedy komórki macierzyste zostają umieszczone w odpowiednim środowisku, mogą dać początek komórkom podobnym do otaczającej je tkanki.
Ponieważ chrząstka stawowa jest pozbawiona naczyń, nerwów i tkanki limfatycznej, chondrocyty nie są w stanie uczestniczyć w procesach gojenia lub naprawy uszkodzonej tkanki, z powodu wspomnianych właściwości macierzy zewnątrzkomórkowej otaczającej komórki chrząstki.
Już od dawna wiadomo, że chrząstka stawowa może stanowić źródło problemów zdrowotnych. W starożytnym Rzymie, lekarz opatrujący rannych po walce gladiatorów, Galen, obserwował ludzkie ścięgna, chrząstki i więzadła i doszedł do wniosku, że ‘atleci (…) chorują na zapalenie stawów’. Około 200 lat temu szkocki lekarz, William Hunter udokumentował uszkodzenia chrząstki, które uznawano za trudne w leczeniu i gojeniu już od czasów Hipokratesa.
Jeśli uszkodzenie chrząstki dotyczy także kości podchrzęstnej, prowadząc do krwawienia, wówczas mezenchymalne komórki macierzyste lub fibroblasty naprawiają ubytek, wytwarzając chrząstkę włóknistą. Niestety, pod względem biomechanicznym chrząstka włóknista jest gorsza niż chrząstka szklista i w efekcie prowadzi to do rozwoju zwyrodnienia stawów. Z tego powodu celem leczenia uszkodzeń chrząstki stawowej jest odbudowa chrząstki o właściwościach chrząstki szklistej, by zapobiec rozwojowi choroby zwyrodnieniowej stawów. Całkowita wymiana stawu kolanowego może pomóc pacjentom w podeszłym wieku, z zaawansowaną chorobą zwyrodnieniową stawów, ale dla młodszych pacjentów jest tylko kilka możliwości. By móc skutecznie leczyć ogniskowe uszkodzenia chrząstki, należy zwrócić uwagę na rozpowszechnienie uszkodzeń chrząstki stawowej, strukturę i charakterystykę chrząstki, reakcję na uraz, podstawy naukowe oraz kliniczne rezultaty różnych metod terapii.
Obecnie żyjemy w 21 wieku, więc dlaczego uszkodzenia chrząstki nadal są takim ‘dokuczliwym problemem’? Żeby odpowiedzieć na to pytanie trzeba wspomnieć trochę więcej na temat struktury chrząstki stawowej, roli którą ona pełni i tego, jak ulega uszkodzeniu.
Jeśli wspomni się o chrząstce kolana, większość ludzi pomyśli o klinowatych amortyzatorach znajdujących się w kolanie – łąkotkach. Jednakże istnieje także inna chrząstka, powodujące dolegliwości w obrębie kolana – chrząstka stawowa – biała tkanka pokrywające przyległe powierzchnie stawów.
Chrząstka stawowa znajduje się we wszystkich ruchomych stawach naszego ciała (tzw. stawach maziówkowych) i jej funkcją jest ochrona kości, poprzez utrzymywanie ich w odległości od siebie, absorbowanie wstrząsów i ułatwianie gładkiego poruszania się. Chrząstka stawowa umożliwia to, ponieważ tworzy ochronną, odporną na ścieranie powierzchnię, znajdującą się na końcu poruszających się kości.
W kolanie chrząstka stawowa pokrywa końce kości udowej (przyśrodkowy kłykieć kości udowej, boczny kłykieć kości udowej i bloczek), górną część kości piszczelowej (plateau piszczeli) i tylną część rzepki.
Chrząstka stawowa jest szczególnym rodzajem chrząstki, noszącym nazwę chrząstki hialinowej (z greckiego ‘hyalos’ oznacza szkło). Chrząstka hialinowa (szklista) jest twardym, białym, błyszczącym materiałem o unikalnej strukturze, tworzącej powierzchnię, która pozwala kościom na swobodne ślizganie się między sobą, gdy staw kolanowy się porusza.
Występują pewne różnice osobnicze, ale generalnie chrząstka ma między 2 a 4 mm grubości w stawie kolanowym i wyjątkowo niski współczynnik tarcia – zaledwie 1/15 wartości współczynnika dla lodu – czyli jest bardzo śliska. Jednakże specyficzny charakter tego materiału sprawia, że jest szczególnie wrażliwy, gdy ulegnie uszkodzeniu.
Urazy chrząstki stawowej są powszechne. Prawidłowa struktura i funkcja chrząstki stawowej może ulec zaburzeniu względnie łatwo, skutkując uszkodzeniem chrząstki. Istnieje kilka scenariuszy, prowadzących do uszkodzenia chrząstki stawowej:
1. Nagłe bezpośrednie uderzenie w chrząstkę (traumatyzujące) np. wysokoenergetyczny uraz, taki jak niefortunny upadek wprost na kolano lub podczas uprawiania sportu.
2. Stopniowe uszkodzenie chrząstki w następstwie urazu kolana (pourazowe).
3. Zużycie chrząstki z czasem (choroba zwyrodnieniowa stawów) – zwłaszcza gdy istnieje nieprawidłowe ustawienie kończyn lub niestabilność stawu i/lub cierpisz na nadwagę.
4. Unieruchomienie na długi okres czasu, ponieważ chrząstka stawowa jest odżywiana podczas ruchów stawu, dlatego brak ruchu może skutkować uszkodzeniem.
5. Oddzielająca jałowa martwica chrzęstno-kostna jest schorzeniem, które powstaje wskutek niedostatecznego ukrwienia leżącej pod chrząstką kości, co prowadzi do oddzielenia fragmentu chrząstki i kości podchrzęstnej, od powierzchni stawowej.
Możliwe jest uszkodzenie wyłącznie chrząstki stawowej, ale zazwyczaj chrząstka ulega uszkodzeniu w połączeniu z innymi tkankami kolana, zwłaszcza więzadłami i łąkotkami. Jeśli uprzednio doszło u Ciebie do uszkodzenia więzadeł i/lub łąkotek, wówczas masz większe ryzyko uszkodzenia chrząstki stawowej, z powodu zmienionej mechaniki stawu, nawet jeśli pierwotne uszkodzenie zostało skutecznie naprawione, np. poprzez rekonstrukcję więzadła krzyżowego przedniego.
Istnieje błędne przekonanie, że uszkodzenie chrząstki stawowej i choroba zwyrodnieniowa stawów dotyczą jedynie osób w wieku 50 lat i starszych. Mimo, że rzeczywiście większy odsetek osób w tej grupie wiekowej cierpi na problemy związane z chrząstką stawową, to młode osoby również doznają uszkodzeń chrząstki, szczególnie podczas uprawiania sportu lub z powodu oddzielającej jałowej martwicy chrzęstno-kostnej.
Jeśli staw kolanowy jest w nieprawidłowej pozycji, jest niestabilny lub rzepka jest przesunięta na jedna stronę, nadmierne obciążenie może być wywierane na poszczególne części powierzchni stawowych i przyśpieszać degeneracyjne zmiany w chrząstce stawowej. Ma to znaczący wpływ na operację rekonstrukcji chrząstki, co zostanie omówione później.
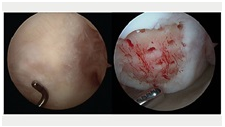
Ryc.1 Uszkodzenie chrząstki stawowej
Schorzenia chrząstki stawowej są trudne do zdiagnozowania. Nie ma specyficznego testu, będącego elementem badania fizykalnego, pozwalającego na wiarygodną diagnozę uszkodzenia chrząstki stawowej, jak to jest np. w przypadku uszkodzenia więzadła. Wielu wskazówek może udzielić opis historii powstania Twojego schorzenia. Czy doszło do jakiegoś specyficznego wydarzenia, gdy pojawiło się uszkodzenie czy tez rozwinęło się ono z czasem? Kiedy i gdzie pojawia się ból, co go nasila, a co zmniejsza, czy problem się pogarsza czy polepsza – ten rodzaj informacji może wskazać właściwy kierunek. Istnieje wiele objawów, które mogą wystąpić, różnią się one znacznie pomiędzy poszczególnymi osobami i często mogą przypominać inne powszechne schorzenia kolana. Możesz odczuwać ból lub nie, możesz mieć opuchliznę. Możesz odczuwać blokowanie się stawu, jeśli fragment chrząstki stawowej został odłamany i porusza się swobodnie w stawie lub możesz mieć wrażenie ‘chwytania’ lub ‘uciekania’ kolana. Możesz mieć osłabienie mięśni i trudności w wykonywaniu takich czynności, jak wchodzenie i schodzenie po schodach, spacerowanie lub bieganie, ale może to dotyczyć każdego pacjenta z jakimkolwiek umiarkowanym urazem kolana. Dlatego też uszkodzenie chrząstki stawowej jest traktowane jak ‘kopciuszek’ wśród problemów ze stawem kolanowym. Zwykle jest diagnozowane dopiero wówczas, gdy schorzenia innych struktur zostaną wykluczone.
Zwykłe zdjęcie rentgenowskie nie jest zbytnio pomocne w diagnostyce uszkodzeń chrząstki stawowej, zwłaszcza we wczesnym stadium, ponieważ uwidoczni ono jedynie uszkodzenie kości. Uszkodzenia chrząstki stawowej często nie są widoczne na zdjęciu rentgenowskim, chyba że istnieje nieprawidłowe ustawienie kości i/lub uszkodzenie kości.
Coraz częściej rezonans magnetyczny jest wykorzystywany w diagnostyce schorzeń chrząstki stawowej i pojawiają nowe metody, specyficzne dla chrząstki, które stają się bardzo wartościowe w ocenie stanu chrząstki stawowej. Jednakże rezonans magnetyczny jest drogim urządzeniem, a skany chrząstki stawowej wymagają dłuższego czasu obrazowania, co niesie za sobą znaczne koszty. Ponadto, czas oczekiwania na badanie rezonansem magnetycznym może być długi w niektórych państwach.
Obecnie złotym standardem w diagnostyce schorzeń chrząstki stawowej jest bezpośrednie obejrzenie wnętrza kolana, za pomocą niewielkiej kamery, podczas zabiegu noszącego nazwę artroskopii. Często uszkodzenie chrząstki jest rozpoznawane dopiero po wykonaniu badania rezonansem magnetycznym lub gdy lekarz obejrzy wnętrze stawu kolanowego podczas artroskopii. To może stanowić prawdziwy problem, z powodu długiego czasu potrzebnego na zidentyfikowanie uszkodzenia chrząstki stawowej i konsekwencji wiążących się z opóźnieniem w diagnostyce.
Jeśli wykonano u Ciebie badanie rezonansem magnetycznym lub artroskopię i wykazano uszkodzenie chrząstki stawowej, chirurg oceni stopień jej uszkodzenia. Do oceny stopnia uszkodzenia powszechnie używa się skali od 0 do 4:
Stopień 0 Chrząstka jest prawidłowa i nienaruszona
Stopień 1 Chrząstka jest lekko zmiękczona i występują pęcherzyki
Stopień 2 Częściowe zmniejszenie grubości (mniej niż 50%) i niewielkie pęknięcia na powierzchni chrząstki
Stopień 3 Głębsze uszkodzenie (powyżej 50%)
Stopień 4 Uszkodzenie na pełnej grubości chrząstki, z odsłonięciem kości podchrzęstnej
Oprócz oceny stopnia uszkodzenia, lekarz zmierzy także wymiary każdego uszkodzonego miejsca, w centymetrach kwadratowych. Za niewielkie uszkodzenia uważa się zmiany mniejsze niż 2 cm2. Następnie ilość uszkodzonej chrząstki stawowej oblicza się, biorąc pod uwagę liczbę zmian, ich głębokość i wymiary. Należy również pamietać, że mimo, iż ilość uszkodzonej tkanki jest ważnym czynnikiem, to lokalizacja uszkodzenia również wpływa na objawy, takie jak ból i upośledzenie funkcji, a także na dostępne metody rekonstrukcji. W szczególności tzw. ‘kissing lesions’ (uszkodzenie chrząstki stawowej na obu sąsiadujących powierzchniach stawowych) może stanowić poważny problem, ponieważ dochodzi wówczas do ocierania kości o kość.
Może zdziwić Cię fakt, że ból nie jest zbyt dobrym wskaźnikiem rozległości uszkodzenia chrząstki stawowej. Jedna osoba może odczuwać silny ból przy obecności jednego małego uszkodzenia, a inna może zgłaszać niewielkie dolegliwości, mając kilka zmian obejmujących pełną grubość chrząstki. Ważny element układanki może zostać przegapiony, jeśli skupimy się zbytnio wyłącznie na chrząstce stawowej. Istotne jest sprawdzenie, co dzieje się w leżącej poniżej kości i wzięcie pod uwagę ogólnego stanu zdrowia stawu kolanowego, by mieć pełen obraz choroby. Na przestrzeni ostatnich 5 lat badacze przyglądali się uważnie całej jednostce chrzęstno-kostnej (chrząstce stawowej i leżącej pod nią kości podchrzęstnej) i istnieje coraz więcej dowodów wskazujących na to, że zmiana w jednym z elementów jednostki chrzestno-kostnej wpływa na drugi.
W większości tkanek to krew jest źródłem niezbędnych składników odżywczych, potrzebnych do regeneracji tkanki. Chrząstka stawowa nie jest zaopatrywana w krew (jest nieunaczyniona) i dlatego ma znacznie ograniczoną zdolność do samodzielnej naprawy. Ogólnie rzecz biorąc, uszkodzenia niepełnej grubości chrząstki nie leczą się samoistnie i z czasem się pogłębiają. W przeciwieństwie do tego, znajdująca się tuż pod chrząstką kość jest obficie unerwiona i unaczyniona. Jeśli uszkodzenie chrząstki stawowej jest płytkie (stopień 1 lub 2), w tym stadium możesz nie odczuwać żadnego bólu spowodowanego uszkodzeniem, ponieważ wrażliwe zakończenia nerwowe znajdujące się w kości podchrzęstnej są nadal pokryte chrząstką stawową. Niektóre osoby mają uszkodzoną chrząstkę stawową i początkowo nawet nie mają o tym pojęcia. Ostatnie badania wykazały, że duża liczba pacjentów poddanych operacji rekonstrukcji więzadła miała uszkodzoną chrząstkę stawową, przy bardzo niewielkich dolegliwościach. Z drugiej strony, kiedy uszkodzenie sięga aż do kości (stadium 4) zakończenia nerwowe w kości podchrzęstnej zostają odsłonięte i istnieje większe ryzyko, że odczujesz ból, zwłaszcza gdy nerwy zostaną uciśnięte.
Kiedy uszkodzenie chrząstki sięga aż do kości, krew zaopatrująca kość podchrzęstną może rozpocząć proces gojenia zmiany. Skutkiem tego jest formowanie tkanki bliznowatej, zbudowanej z typu chrząstki, noszącego nazwę chrząstki włóknistej. Mimo, że chrząstka włóknista może wypełnić uszkodzenia w chrząstce stawowej, to jej struktura znacząco różni się od chrząstki szklistej. Chrząstka włóknista jest znacznie gęstsza i nie jest w stanie sprostać wymaganiom codziennej aktywności, tak dobrze jak chrząstka szklista, dlatego istnieje większe ryzyko jej uszkodzenia.
Jeśli dany obszar jest niestabilny, fragmenty chrząstki stawowej mogą się odłamać od kości podchrzęstnej i otaczającej chrząstki i przemieszczać się w obrębie stawu kolanowego. Te fragmenty mogą nie tylko powodować problem mechaniczny, poprzez klinowanie i blokowanie, ale także pobudzać chemiczne zmiany w stawie kolanowym, gdy fragmenty ulegną rozkładowi, co prowadzi do stanu zapalnego tkanki wyściełającej staw (zapalenie błony maziowej).
To jest pytanie za milion dolarów, na które każdy pacjent z uszkodzeniem chrząstki stawowej chciałby znać odpowiedź. Czy moje uszkodzenie chrząstki stawowej będzie się pogłębiać i doprowadzi do choroby zwyrodnieniowej stawów?
Najnowsze badania wykazały, że niewielkie uszkodzenia chrząstki stawowej z czasem prowadzą do choroby zwyrodnieniowej stawów. Inne obserwacje sugerują, że niektóre uszkodzenia ulegają naprawie chrząstką włóknistą i mogą przetrwać wiele lat.
Które uszkodzenia prowadzą do choroby zwyrodnieniowej stawów? Jeszcze nie jest jasne, które czynniki są związane z jakąkolwiek progresją, ale pojawiła się koncepcja, że istnieje proces utraty chrząstki stawowej w miarę upływu lat (chondropenia). Ważną kwestią jest fakt, że jest to PROCES. Uszkodzenie chrząstki stawowej, które początkowo może być stosunkowo niewielkie, nadal ma potencjał wywołania fizycznego i chemicznego ‘efektu domina’ na otaczającą prawidłową chrząstkę. Nadmierne obciążenie powierzchni stawowej, która już ma uszkodzoną chrząstkę, może przyśpieszać dalsze zmiany degeneracyjne. Skorygowanie współistniejącego nieprawidłowego ustawienia lub niestabilności może pomoc w normalizacji obciążenia. Istnieją dowody wskazujące na to, że uszkodzenia chrząstki stawowej, które nie mają wyraźnie zaznaczonego brzegu i mają słabe oparcie również pociągają za sobą zwiększone ryzyko progresji.
Tak więc, czy naprawa chrząstki stawowej jest tylko opóźnianiem tego, co nieuchronne, jeśli chodzi o chorobę zwyrodnieniową stawu kolanowego? Na obecną chwilę nikt nie zna jednoznacznej odpowiedzi na to pytanie. Obecnie nie ma konkretnych dowodów na to, że naprawa uszkodzonej chrząstki stawowej może zapobiec progresji uszkodzenia do choroby zwyrodnieniowej stawów. Prowadzone badania dają obiecujące wyniki, ale większość z nich ma jak na razie krótki okres obserwacji, dlatego rezultaty długoterminowe jeszcze są niepewne.
Wydaje się, że naprawa uszkodzeń chrząstki stawowej może spowolnić degenerację stawu, w porównaniu z pozostawieniem schorzenia bez leczenia. Dlatego też obecnie procedury naprawy chrząstki stawowej są leczeniem nakierowanym na zmniejszenie dolegliwości i poprawę funkcji. Zabiegi naprawy chrząstki stawowej BYĆ MOŻE spowalniają progresję uszkodzenia do choroby zwyrodnieniowej stawów w późniejszym życiu, ale nadal nie jest to jednoznacznie rozstrzygnięte.
Głównym celem każdej metody leczenia jest odbudowa powierzchni stawowej za pomocą prawidłowej chrząstki szklistej. Od ostatnich dwóch dekad stanowi to wyzwanie dla chirurgów i doprowadziło do rozwoju szeregu procedur chirurgicznych, które zostaną omówione później. Wiele z tych procedur pozwala na uzupełnienie ubytków spowodowanych uszkodzeniem chrząstki stawowej, ale nawet w najbardziej obiecujących zabiegach nowa tkanka nie jest identyczna jak naturalna chrząstka stawowa. Bliznowata tkanka może przypominać chrząstkę szklistą, ale nie ma tych samych właściwości mechanicznych – jest tylko do niej podobna. Tak więc na obecną chwilę nie możemy odtworzyć struktury prawidłowej chrząstki stawowej, ale możemy naprawić uszkodzenie podobną tkanką.
Jeśli nie można przywrócić prawidłowej struktury chrząstki stawowej, po co brać pod uwagę zabieg chirurgiczny, żeby naprawić uszkodzenie tkanką, która nie będzie tak samo dobra? Rekonstrukcja chrząstki stawowej niesie za sobą ryzyko, takie jak każda inna operacja chirurgiczna i zawsze powinieneś mieć dobry powód, by decydować się na jakąkolwiek operację. Czy bliznowata tkanka podobna do chrząstki szklistej jest wystarczająco dobra, by poddawać się operacji chirurgicznej?
Chociaż uszkodzenie chrząstki stawowej nie zagraża życiu, to zazwyczaj tak się dzieje, że pogarsza jakość życia, ponieważ powoduje nie tylko ból, ale również opuchliznę, upośledzoną ruchomość i ograniczenia w Twojej aktywności.
Dzięki odtworzeniu kości podchrzęstnej podczas zabiegu rekonstrukcji chrząstki stawowej, ból może zostać znacznie zredukowany, a powierzchnia stawowa odtworzona.
Pytania o to, jak długo może przetrwać tkanka bliznowata i jak jest wytrzymała, w porównaniu ze zdrową chrząstką stawową, nadal pozostają bez odpowiedzi. Rekonstrukcja chrząstki stawowej jest względnie nową techniką i wciąż istnieje wiele znaków zapytania. Rośnie liczba badań klinicznych, obserwujących pacjentów po rekonstrukcji chrząstki stawowej przez dłuższy okres czasu, by określić w jakim stanie i jak długo przetrwa naprawiona chrząstka stawowa.
Istnieje wiele metod rekonstrukcji chrząstki stawowej powszechnie stosowanych i jeszcze więcej w trakcie rozwoju. Wybór metody może być skomplikowany, zwłaszcza jeśli chirurg zaproponuje Ci kilka opcji. Jedną z przyczyn, dla których wybór ten sprawia trudności, jest fakt, że różne procedury zwykle nakładają się na siebie, dlatego możesz być dostępna więcej niż jedna opcja.
Metody naprawy chrząstki stawowej różnią się stosowaną technologią i procedurą chirurgiczną, ale wszystkie mają na celu rekonstrukcję chrząstki, z jednoczesnym zachowaniem dostępności innych opcji, które mogą się okazać potrzebne w przyszłości. Dzięki temu, wybierając jedną z metod, nie zamykasz sobie drogi dostępu do innej.
Z perspektywy pacjenta głównymi argumentami przemawiającymi za poddaniem się rekonstrukcji chrząstki stawowej są:
• Uśmierzenie bólu
• Poprawa funkcji
• Możliwość zmniejszenia progresji uszkodzenia
• Możliwość opóźnienia konieczności operacji wszczepienia protezy stawu kolanowego
Rehabilitacja następująca po jakimkolwiek zabiegu naprawy chrząstki stawowej jest długa i wymagająca. Istnieje wiele różnych schematów rehabilitacji, dlatego w tym artykule nie zostaną podane konkretne wytyczne. Jeśli planujesz lub już przeszedłeś zabieg rekonstrukcji chrząstki stawowej, otrzymasz program rehabilitacji dostosowany do wykonanego zabiegu i Twoich indywidualnych potrzeb. Ten akapit pozwoli Ci zrozumieć, dlaczego rehabilitacja jest tak ważna i poznasz ogólne zasady rehabilitacji po rekonstrukcji chrząstki stawowej.
Po pierwsze odpowiedzmy sobie na pytanie ‘Dlaczego rehabilitacja odbywa się tak długo po zabiegu rekonstrukcji chrząstki stawowej?’
Cóż, głównym powodem jest czas potrzebny, by komórki chrząstki mogły się przystosować i dojrzeć do tkanki naprawczej – chrząstka bardzo powoli się adaptuje. Żeby lepiej to sobie uzmysłowić, można porównać czas pełnej adaptacji mięśnia, który zajmuje około 35 tygodni, z chrząstką, która adaptuje się zaledwie w 75% w ciągu 2 lat! Rehabilitacja musi odzwierciedlać stopniowe przystosowywanie się naprawionej chrząstki i dlatego jest wolniejsza, niż programy rehabilitacyjne opracowywane dla innych tkanek, np. więzadła krzyżowego przedniego. Progresja rehabilitacji jest zawsze ograniczona tempem adaptacji najwolniejszej tkanki, dlatego w przypadku tkanki chrzęstnej rehabilitacja może trochę potrwać. Jeżeli rehabilitacja będzie postępować zbyt szybko, nowa tkanka chrzęstna zostanie poddana zbyt dużemu obciążeniu i jako najsłabsze ogniwo może nie wytrzymać.
Celem leczenia ogniskowego uszkodzenia chrząstki jest umożliwienie pacjentowi powrotu do wykonywania codziennych czynności i aktywnego stylu życia, poprzez uwolnienie go od bólu i poprawienie funkcji stawu. Wybór metody leczenia powinien być oparty o poziom aktywności pacjenta, jego wiek, przyczynę schorzenia, rozmiar i stopień zaawansowania uszkodzenia oraz obecność dodatkowych schorzeń. Do dostępnych metod leczenia zaliczają się: leczenie zachowawcze oraz leczenie operacyjne mające na celu uwolnienie pacjenta od dolegliwości lub rekonstrukcję chrząstki stawowej.
Leczenie zachowawcze uszkodzeń chrząstki stawu kolanowego jest skuteczne w uśmierzaniu bólu, ale nie ma zastosowania w rekonstrukcji chrząstki stawowej. Badania sugerują, że leczenie zachowawcze jest odpowiednie dla leczenia umiarkowanego bólu lub gdy ryzyko operacji jest wyższe niż spodziewane korzyści. Wykazano, że leczenie zachowawcze nie jest skuteczne w zapobieganiu rozwijaniu się uszkodzenia: kliniczne wyniki były dobre, ale badania radiologiczne wykazywały nieprawidłowości u >50% pacjentów. Do zachowawczych metod leczenia zalicza się stosowanie niesteroidowych leków przeciwzapalnych (NLPZ), leków przeciwbólowych, hormonów (estrogenów i hormonu wzrostu), czynników chondroprotekcyjnych (glukozamina i fosforan chondroityny oraz kwasy omega-3), iniekcje dostawowe ze steroidów lub kwasu hialuronowego, redukcję masy ciała, celem zmniejszenia obciążenia stawów kolanowych, stabilizatory i fizjoterapię. Niestety, metody te mogą być przydatne jedynie w leczeniu objawów, a nie w celu przywrócenia strukturalnej integralności chrząstki stawowej.
Celem leczenia chirurgicznego jest zmniejszenie objawów i zapobieganie zmianom degeneracyjnym, poprzez strukturalną i biomechaniczną odbudowę chrząstki stawowej. Metody leczenia operacyjnego można z grubsza podzielić na: artroskopowe płukanie i czyszczenie, terapię komórkową (stymulacja kości podchrzęstnej do różnicowania w kierunku tkanki chrzęstnej lub hodowla i implantacja chondrocytów), terapię tkankową (auto- lub alloprzeszczepy kostno-chrzęstne). Wady i zalety każdej metody, rozmiar, lokalizacja i głębokość zmiany, a także wiek i poziom aktywności pacjenta powinny zostać ocenione w celu wyboru najlepszej opcji leczenia. Najważniejszymi czynnikami, które należy wziąć pod uwagę, są: przyczyna i charakterystyka uszkodzenia chrząstki. Uszkodzenie chrząstki może być ogniskowe lub degeneracyjne. Celem leczenia zmian ogniskowych należy przeprowadzić odpowiednie oczyszczanie, żeby pozostawić przyległy obszar zdrowej chrząstki dla pomyślnej odbudowy strukturalnej i biomechanicznej. Dla odmiany, w przypadku zmian degeneracyjnych, w których obszar uszkodzenia i strefa przejściowa są rozlegle, proces oczyszczenia może dodatkowo wymagać następczych metod terapii lub skutkować niepomyślnymi wynikami. Ponadto, słaba regeneracja komórek i tkanek może skutkować niesatysfakcjonującym rezultatem po operacji. Dlatego też przyczyna i charakterystyka uszkodzeń chrząstki powinny być brane pod uwagę przy wyborze leczenia operacyjnego.
Obecnie zmieniono technikę zabiegu z dostępu otwartego na płukanie i oczyszczanie podczas artroskopii. Celem płukania podczas artroskopii jest usunięcie mediatorów zapalnych, które mogą być odpowiedzialne za obecność wysięku w obrębie stawu oraz luźnej chrząstki i resztek kolagenu.
Oczyszczanie chrząstki stawowej (chondroplastyka) jest zabiegiem polegającym na usuwaniu niestabilnych fragmentów chrząstki lub brzegów chrząstki, które mogą uszkadzać staw, za pomocą skrobaka lub golarki, celem uśmierzenia bólu stawu i zapobiegania dalszej destrukcji chrząstki stawowej. Naprawa artroskopowa może być pomocna w zapobieganiu postępowi rozwarstwienia chrząstki stawowej, ale istnieją kontrowersje co do jej wpływu na długoterminową żywotność chrząstki stawowej.
Terapia komórkowa jest obiecującą metodą wykorzystującą własne komórki pacjenta do leczenia uszkodzeń chrząstki. Dostępne są procedury stymulacji szpiku oraz zabiegi wszczepiania autologicznych chondrocytów. Do procedur stymulacji szpiku zaliczają się: artroplastyka abrazyjna, nawiercanie i metoda mikrozłamań. Pierwsze dwie procedury są rzadko wykonywane, z powodu niezadowalających wyników klinicznych.
a) Metoda mikrozłamań jest techniką naprawy chrząstki stawowej, podczas której wykonuje się drobne złamania w odległości 2-4 mm od siebie, żeby spowodować krwawienie w obrębie kości podchrzęstnej, następnie skrzepy włóknika uwalniają komórki macierzyste mezenchymalne, które mogą różnicować się w kierunku chondrocytów. Wielopotencjalne mezenchymalne komórki macierzyste mogą różnicować się w kierunku komórek chrząstki włóknistej i chondrocytów oraz pobudzać syntezę chrząstki włóknistej lub tkanki podobnej do chrząstki szklistej.
Chrząstka włóknista zawiera więcej kolagenu i mniej proteoglikanów w porównaniu z chrząstką szklistą. Ma w swoim składzie więcej kolagenu typu I niż typu II. Kolagen typu I cechuje się mniejszą wytrzymałością na ucisk, mniejszą elastycznością i odpornością na zużywanie, w porównaniu z kolagenem typu II. Ponadto, naprawa uszkodzenia chrząstką włóknistą skutkuje nawrotem schorzenia, pod wpływem powtarzalnego mechanicznego obciążania. Dodatkowo, liczba mezenchymalnych komórek macierzystych jest niewielka i zmniejsza się wraz z upływem czasu. Mimo wspomnianych wad, technika mikrozłamań jest preferowana ze względu na to, iż nie powoduje uszkodzeń w obrębie zdrowej tkanki oraz jest łatwa w wykonaniu i relatywnie tania.
Metoda mikrozłamań może być stosowana w przypadku niestabilności i zmian ogniskowych obejmujących pełną grubość chrząstki oraz u pacjentów ze zmianami zwyrodnieniowymi stawów z prawidłowym ustawieniem kończyn dolnych. Zabieg jest przeciwwskazany u pacjentów z zapaleniem stawów, nieprawidłowym ustawieniem kończyn dolnych, zmianami sięgającymi niepełnej grubości chrząstki oraz niechętnych do podjęcia rehabilitacji. Należy wziąć pod uwagę również inne czynniki. Im starszy pacjent, tym gorszy wynik leczenia. Zmiany pourazowe cechują się lepszym wynikiem leczenia w porównaniu ze zmianami degeneracyjnymi. Teoretycznie metoda mikrozłamań może być stosowana niezależnie od wielkości zmiany. Jednakże badania wykazały, że zmiany większe niż 400 mm2 gorzej odpowiadają na leczenie. Ponadto, im większe BMI, tym gorszy wynik leczenia. Procedura zabiegu składa się z oczyszczania i nawiercania. Zabieg oczyszczania powinien zostać przeprowadzony dokładnie. Wszelka luźna chrząstka powinna zostać całkowicie usunięta, żeby miejsce uszkodzenia było otoczone przez zdrową tkankę, oraz by uformować prostopadłe brzegi, pozwalające na odpowiednie uciśnięcie zmiany. Wykonuje się to celem umożliwienia dokładnego przylegania skrzepów szpiku do uszkodzonego miejsca oraz zmniejszenia bezpośredniego obciążenia wywieranego na uszkodzone miejsce, co ułatwia gojenie. Pozostałości zwapniałej chrząstki powinny być całkowicie usunięte, ponieważ utrudniają przyleganie gojącej się tkanki. Podczas zabiegu należy unikać nadmiernego uszkodzenia kości podchrzęstnej. Nawiercanie kości podchrzęstnej powinno być wykonywane dośrodkowo, od brzegów zmiany w kierunku jej centrum. Otwory powinny znajdować się w odległości 3-4 mm od siebie i mieć około 4-5 mm głębokości.
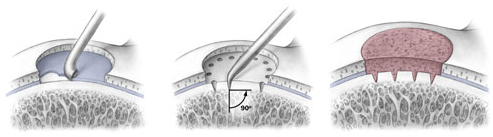
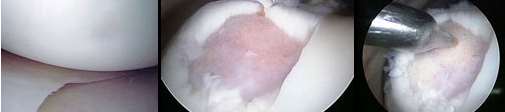
Ryc. 2 Etapy zabiegu metodą mikrozłamań:
Po lewej: usunięcie uszkodzonej chrząstki. Na środku: Za pomocą specjalnego dłuta wykonywane są otwory w kości podchrzęstnej. Po prawej: Proces gojenia powoduje powstanie nowej zdrowej tkanki chrzęstnej.
Po zabiegu stosuje się różne rodzaje rehabilitacji, w zależności od lokalizacji zmiany. W przypadku zmian dotyczących stawu udowo-piszczelowego, natychmiast po operacji rozpoczyna się bierne ćwiczenia zwiększające zakres ruchomości. Całkowity zakres ruchu udaje się przywrócić po około 6-8 tygodniach chodzenia o kulach i regularnego wykonywania biernych ćwiczeń zwiększających zakres ruchomości. Dla zmian w obrębie stawu udowo-rzepkowego należy zastosować stabilizator umożliwiający ruch w zakresie 0-20 stopni.
Podsumowując, badania wykazały, że technika mikrozłamań może być skuteczna w zmniejszaniu objawów uszkodzeń chrząstki, ale z czasem dolegliwości nasilają się, a niesatysfakcjonujący wynik leczenia może być skutkiem zaawansowanego wieku, znacznych rozmiarów zmiany oraz dużego poziomu aktywności fizycznej.
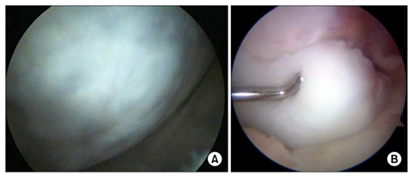
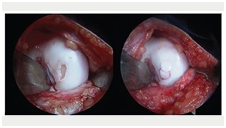
Ryc. 3 Artroskopowy obraz po wykonaniu zabiegu metodą mikrozłamań.
Ryc. 4 Po lewej: prawidłowa chrząstka stawowa. Na środku: Duże uszkodzenie chrząstki w stawie kolanowym. Po prawej: Podczas zabiegu mikrozlamań dłuto penetruje zmienione chorobowo miejsce.
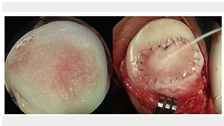
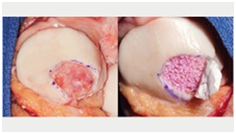
b) Autologiczny przeszczep chondrocytów (ACI). ACI jest dwuetapową procedurą, podczas której chondrocyty są pobierane z nieobciążanej części chrząstki i wszczepiane w miejsce uszkodzenia. W porównaniu z innymi metodami leczenia defektów chrząstki, ACI powoduje mniejsze uszkodzenie kości podchrzęstnej i beleczkowatej, może być przeprowadzany w przypadku większych zmian, nie wywołuje dolegliwości ani powikłań w miejscu pobrania i jest względnie łatwy w wykonaniu.
Procedura wymaga nacięcia stawu, musi być przeprowadzana w dwóch etapach i wymaga długiego okresu rehabilitacji. Najlepszymi kandydatami do ACI są pacjenci w wieku pomiędzy 15 a 55 lat, z uszkodzeniem sięgającym pełnej grubości chrząstki lub niestabilną oddzielającą martwicą kostno-chrzęstną. Jeżeli jest to konieczne, ACI może być poprzedzone zabiegami wykonywanymi z powodu nieprawidłowego ustawienia kończyn dolnych lub niestabilnością więzadeł. Najlepiej jeśli zmiana przeznaczona do zabiegu ma od 2 do 10cm2. W przypadku zmian kostno-chrzęstnych, ACI może być przeprowadzone jeśli uszkodzenie ma 6-8 mm głębokości, głębsze zmiany wymagają przeszczepu kostnego poprzedzającego ACI. Najlepsze rezultaty daje ACI w przypadku zmian w obrębie kłykcia kości udowej. ACI jest przeciwwskazane u pacjentów, którzy nie poddają się rehabilitacji lub mają zapalenie stawów bądź tzw. ‘kissing lesion’.
Pierwszy etap ACI polega na artroskopowej kontroli zmiany, celem oceny jej rozmiarów, głębokości i potencjalnej utraty kości. Następnie pobiera się chondrocyty za pomocą dłuta lub skrobaka, z miejsca o niskim obciążeniu, takim jak boczny brzeg kresy międzykrętarzowej lub bloczek kości udowej. Pobiera się około 200-300 mg tkanki. Należy dosięgnąć kości podchrzęstnej, by umożliwić gojenie się miejsca pobrania.
Drugi etap zabiegu jest wykonywany 4 tygodnie po biopsji, kiedy wyhodowana zostanie odpowiednia ilość komórek. Wszelka niestabilna lub uszkodzona chrząstka zostaje usunięta, żeby zmiana chorobowa była otoczona stabilną i zdrową tkanką. Otaczająca chrząstka powinna mieć 2-3 mm grubości, by umożliwić przytwierdzenie graftu. Należy unikać uszkodzenia kości podchrzęstnej, które mogłoby spowodować krwawienie ze szpiku i skażenie przeszczepianych chondrocytów niezróżnicowanymi komórkami.
Następnie zmienione chorobowo miejsce zostaje pokryte okostną. Miejsce zabiegu zostaje zamknięte szwami i zabezpieczone klejem fibrynowym.
Rehabilitacja po ACI to długi i wymagajacy proces, ponieważ jest terapią komorkową, podobnie jest metoda mikrozlamań. Przebieg rehabilitacji zalezy od od lokalizacji uszkodzenia i stanu operowanego miejsca. Obciążanie i poruszanie kolanem jest zabronione przez 12-18 godzin po operacji, dopóki chondrocyty nie osadzą się wewnątrz chrzastki stawowej. Przez pierwsze 4 tygodnie po zabiegu wykonuje się cwiczenia bierne przez 6-8 godzin dziennie. Przez pierwsze dwa tygodnie po operacji zabronione jest obciazanie. Między 2 a 4 tygodniem dopuszczalne jest obciążanie 10-20 kg, a miedzy 4 a 6 tygodniem dozwolone jest chodzenie o kulach. Stopniowo zwiększa się obciążenie przez 12 tygodni, az do pelnego obciazenia.
Przed upływem 2 tygodni od operacji, kolano powinno być unieruchomione za pomocą stabilizatora w pełnym wyproście, z wyjątkiem przypadków gdy stosowane są ćwiczenia z maszyną CPM lub ćwiczenie stawu. Zakres ruchu powinien być stopniowo zwiększany przy użyciu maszyny CPM.
Badania kliniczne wykazały dobre i świetne wyniki u większości pacjentów poddanych ACI. Kontrolna artroskopia wykazała prawidłowy obraz chrząstki u 90% pacjentów, a obecność chrząstki szklistej została potwierdzona badaniem histologicznym u większości osób. Czynniki, które mogą wpływać na wynik ACI również były przedmiotem wielu badań. Wykazano, że uprzednie wykonanie procedury z wykorzystaniem technik stymulacji szpiku, takich jak metoda mikrozłamań, zwiększa ryzyko niepowodzenia ACI. Słabe rezultaty obserwowano również u pacjentów z rozległymi lub mnogimi zmianami w obrębie chrząstki. Im dłuższy był okres utrzymywania się objawów, tym gorsze były wyniki kliniczne. Pacjenci w wieku poniżej 30 lat, o dużej aktywności mieli dobre rezultaty po zabiegu ACI. Badania wskazują, że różne czynniki powinny być brane pod uwagę, by osiągnąć satysfakcjonujący wynik zabiegu. Pierwsza generacja ACI często była związana z powikłaniami okostnowymi. U większości pacjentów po ACI obserwowano poprawę kliniczną, ale badanie rezonansu magnetycznego ujawniało okostnową hipertrofię u 28% wszystkich pacjentów i 50% pacjentów po ACI kolana.
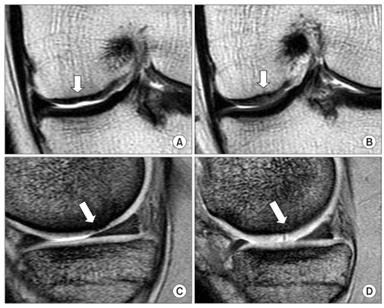
Ryc. 5 Obraz MRI przed i po autologicznym przeszczepie chondrocytów (ACI).
(A) Przekrój czołowy przedstawia ogniskowe uszkodzenie chrząstki z jej ścieńczeniem. (B) Przekrój czołowy przedstawia lekko hiperintensywną naprawioną tkankę, 26 miesięcy po ACI. (C)Obraz T2 w przekroju strzałkowym przedstawia ścieńczenie chrząstki i nieregularne uniesienie kości podchrzęstnej. (D)Obraz T2 w przekroju strzałkowym przedstawia hipertrofię zregenerowanej chrząstki z miejscowym hiperintensywnym obszarem, po 26 miesiącach od ACI.
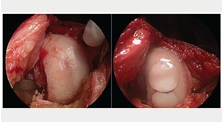
Ryc. 6 Zmiany wykazane w kontrolnej artroskopii po zabiegu ACI.
(A) Zregenerowana tkanka podobna do chrząstki szklistej po zabiegu ACI, jej powierzchnia wykazuje gładki i dobrze wbudowany brzeg. (B) Hipertrofia graftu po ACI pierwszej generacji, powodująca blokowanie się kolana.
Pierwsza generacja ACI została zastąpiona drugą i trzecią generacją, żeby zapobiec powikłaniom okołookostnowym i uzyskać strukturalnie i biomechanicznie lepszą tkankę. ACI drugiej generacji jest procedurą, w której syntetyczna błona kolagenowa, zamiast okostnowej powłoki, jest przyszywana w miejscu uszkodzenia, a następnie wstrzykiwane są chondrocyty. Trzecia generacja ACI jest zabiegiem, w którym chondrocyty są hodowane na biodegradowalnym rusztowaniu, które zostanie wszczepione w miejsce uszkodzenia.
Mimo, że różne badania analizowały rezultaty każdej z wymienionych procedur, powinny one zostać jeszcze potwierdzone dalszymi obserwacjami.
ACI jest skuteczne w podtrzymywaniu dobrego rezultatu klinicznego przez długi okres czasu, ale do jej wad należy fakt, że wymaga dwóch osobnych procedur pobrania i wszczepienia chondrocytów, a nacięcie stawu jest nieuniknione w większości przypadków podczas implantacji. Rozwój drugiej i trzeciej generacji ACI sprawił, że zabieg może być przeprowadzany metodą artroskopową, przez co łatwiej go wykonać. Oczekuje się, że w przyszłości będą się pojawiać dalsze udoskonalenia.
Ryc. 7 Autologiczny przeszczep chondrocytów (ACI)
Do metod terapii tkankowej zaliczają się: autoprzeszczep chrzęstno-kostny, alloprzeszczep chrzęstno-kostny oraz implantacja rusztowania tkankowego (tzw. skafoldu). Zaletami tych metod są: leczenie uszkodzenia w jednym etapie, sprzyjanie powrotowi do codziennej aktywności i uprawiania sportu przy zastosowaniu biomechanicznie zdrowej tkanki oraz utrzymywanie się rezultatów pooperacyjnych przez długi okres czasu, dzięki naprawie chrząstki szklistej. Ponieważ wszczepianie rusztowania tkankowego może być zastosowane przy ograniczeniach klinicznych i tylko niewielka liczba wyników została udokumentowana, artykuł skupi się na dwóch pierwszych metodach leczenia.
a) Autoprzeszczep chrzęstno-kostny (OAT, plastyka mozaikowa)
OAT pozwala na naprawę uszkodzeń chrząstki za pomocą chrząstki szklistej. Do zalet tej metody zaliczają się: 1) jest to procedura jednoetapowa, w przeciwieństwie do ACI; 2) może być wykonane metodą artroskopową przy niewielkich zmianach; 3) bloczki chrzęstno-kostne można pobrać bez problemu; 4) jest to terapia tkankowa, która pozwala na wcześniejszą rehabilitację, w porównaniu z terapią komórkową; 5) może być przeprowadzona przy niższych kosztach w porównaniu z ACI; 6) uszkodzenie zostaje pokryte chrząstką szklistą; 7) ma niewiele skutków ubocznych. Jedną z wad zabiegu jest fakt, że nie może być stosowany w przypadku dużych zmian, z powodu ograniczonych możliwości miejsca będącego źródłem pobieranej tkanki (miejsca dawczego). W przypadku rozległych zmian konieczna jest duża liczba bloczków chrzęstno-kostnych i trudno jest dopasować wielkość i kierunek ustawienia wszczepianych bloczków do przylegającej tkanki chrzęstnej. Przerwy między bloczkami chrzęstno-kostnymi oraz między bloczkami a otaczającą chrząstką są wypełniane chrząstką włóknistą. Ponadto, pourazowe zapalenie stawów może rozwinąć się w stawie rzepkowo-udowym, wskutek pobrania przeszczepu.
Pierwotnym wskazaniem dla OAT jest objawowe uszkodzenie chrząstki stawowej (stadium 3 lub 4 wg Outerbridge), które ma 1-4 cm2 wielkości, u pacjentów poniżej 45 roku życia. Do przeciwwskazań należą: wiek powyżej 50 roku życia, zmiany większe niż 8 cm2, umiarkowana lub ciężka choroba zwyrodnieniowa stawów, zapalenie stawów, brak odpowiedniego miejsca dawczego oraz nieprzestrzeganie rehabilitacji. Zaburzenia w ustawieniu kończyn dolnych oraz współistniejące uszkodzenia więzadeł powinny być zbadane i wyleczone przed przystąpieniem do OAT.
Procedura składa się z wypreparowania miejsca uszkodzenia, pobrania przeszczepu przy pomocy cylindrycznego dłuta, wyjęcia przeszczepu z dłuta i wszczepienia graftu. Podczas preparowania uszkodzonego miejsca niestabilna chrząstka jest usuwana, a zmiana jest mierzona, żeby określić wymiary, ilość i układ bloczków chrzęstno-kostnych. Najpopularniejszymi miejscami pobierania tkanki jest górno-boczna część kresy międzykrętarzowej kości udowej oraz przyśrodkowy/boczny brzeg bloczka kości udowej. Bloczek chrzęstno-kostny może zostać pobrany przy użyciu cylindrycznego dłuta, a odpowiednia długość wynosi 15 mm. Ważne jest skierowanie cylindrycznego dłuta prostopadle do powierzchni stawowej, żeby uzyskać graft o odpowiedniej wielkości. Następnym etapem jest wszczepienie bloczka chrzęstno-kostnego w miejsce uszkodzenia, na co składa się wiercenie, dylatacja i umieszczenie. Odpowiednio dobrana rozmiarem prowadnica dla wiertła jest umieszczana prostopadle do ścian zmiany, następnie wiertło o takiej samej średnicy jest wprowadzane, by wytworzyć tunel w obrębie zmiany. Tunel powinien być około 2 mm dłuższy niż graft i rozszerzony dylatatorem o tej samej średnicy. Przeszczep jest ostrożnie wbijany do otworu, przy użyciu specjalnego ubijaka, by uniknąć obumierania chondrocytów. Jeśli potrzebne jest wszczepienie kilku graftów, zabieg jest powtarzany dla każdego przeszczepu, by zwiększyć mechaniczną stabilność. Kluczowe jest upewnienie się, że powierzchnia stawowa przeszczepu znajduje się na tej samej wysokości, co przyległa powierzchnia stawowa. W jednym z badań wykazano, że gdy przeszczep był umieszczony nieco głębiej niż otaczająca powierzchnia stawowa, nacisk był prawidłowy, natomiast uniesienie o 2 mm powodowało 50% wzrost ciśnienia. W badaniach przeprowadzonych na zwierzętach, martwica chrząstki i przerost tkanki włóknistej były obserwowane, gdy przeszczepy umieszczano 2 mm poniżej otaczającej je chrząstki stawowej.
OAT pozwala na szybką rehabilitację. Wykonywanie biernych ruchów i podnoszenie wyprostowanej nogi są możliwe od razu po operacji. Obciążanie jest dopuszczalne w zależności od ilości wszczepionych graftów. Generalnie chodzenie bez obciążania lub chodzenie na palcach, przy użyciu kul jest dozwolone przez dwa tygodnie po operacji. Częściowe obciążanie jest dopuszczalne po 2-4 tygodniach po operacji, a pełne obciążanie jest możliwe od 4 lub 6 tygodnia po zabiegu.
Kliniczne rezultaty OAT są stosunkowo korzystne. Wiele badań wykazało, że zabieg był skuteczny u 76-93% pacjentów, pod względem osiągnięcia poprawy klinicznej. Jednakże są pewne czynniki, które mogą wpływać na rezultat kliniczny. Badania wykazały, że duży odsetek powikłań lub konieczności reoperacji występował u pacjentów z dużymi zmianami. Zaobserwowano również, że mimo, iż OAT miał dobre wyniki kliniczne, to poprawa była mniej wyraźna u pacjentów ≥30 roku życia lub ze zmianami ≥4 cm2 .
Ryc. 8 Autoprzeszczep chrzęstno-kostny (OAT)
b) Alloprzeszczep chrzęstno-kostny
Jeśli uszkodzenie chrząstki jest zbyt duże, by wykonać autoprzeszczep, można wziąć pod uwagę alloprzeszczep. Allograft jest przeszczepem tkankowym od dawcy zmarłego. Podobnie jak w autoprzeszczepie, jest to blok chrząstki i kości. W laboratorium zostaje wysterylizowany i odpowiednio przygotowany. Jest przebadany pod kątem jakiejkolwiek możliwości przeniesienia choroby. Alloprzeszczep jest standardowo większy niż autoprzeszczep. Zostaje uformowany, by pasować bezpośrednio do konturów uszkodzenia, a następnie wciśnięty na odpowiednie miejsce.
Allografty są standardowo wykonywane z dostępu otwartego. Alloprzeszczep chrzęstno-kostny może być wykonywany niezależnie od wielkości uszkodzenia oraz dostępności miejsca dawczego. Zabieg może być wykonywany celem leczenia dużych zmian, ≥10 cm2 wielkości. Do wad zabiegu należą: trudność w pobraniu graftu w odpowiednim czasie, duże koszty i możliwość immunologicznej reakcji odrzucania oraz przeniesienia choroby.
Ze względu na typ przeszczepu, wyróżniamy powierzchowne i głębokie allografty. Powierzchowne allografty zawierają <1 cm kości podchrzęstnej, a głębokie przeszczepy zawierają głębsze warstwy kości podchrzęstnej. Jeśli chodzi o metody przechowywania przeszczepu, wyróżniamy świeże allografty, kriokonserwowane mrożone allografty i świeżo mrożone allografty. Świeże allografty są przechowywane w temperaturze 4oC i wszczepiane w ciągu 1 tygodnia od pobrania. W porównaniu z innymi przeszczepami, świeże allografty mają względnie wysokie ryzyko wywołania immunologicznej reakcji odrzucania lub przeniesienia choroby, ponieważ trudno jest całkowicie usunąć krew dawcy z przeszczepu. Kriokonserwacja (krioprezerwacja) jest procesem, podczas którego allografty są przechowywane w glicerolu lub dimetylosulfotlenku, żeby zminimalizować obumieranie chondrocytów i utrzymać ich żywotność. Jest to skuteczne w długoterminowym przechowywaniu tkanek i zapobieganiu reakcji odrzucania oraz przeniesieniu choroby, ale wiąże się z niskimi wskaźnikami przeżywalności chondrocytów. Jeśli chodzi o świeżo mrożone tkanki, przeszczepy są zamrażane w temperaturze -80oC natychmiast po pobraniu i niosą niewielki ryzyko infekcji lub odpowiedzi immunologicznej. Zabieg ten jest mniej kosztowny niż kriokonserwacja. Jednakże chondrocyty ulegają zniszczeniu podczas zamrażania, a biomechaniczne właściwości macierzy zewnątrzkomórkowej pogarszają się w miarę upływu czasu.
Do wskazań do alloprzeszczepu chrzęstno-kostnego należą: pourazowe zwyrodnienie stawów w połączeniu z rozległymi uszkodzeniami chrząstki lub uszkodzenie kości podchrzęstnej u aktywnych pacjentów, oddzielająca jałowa martwica chrzĘstno-kostna i miejscowa jałowa martwica.
Do przeciwwskazań należą: umiarkowana lub ciężka choroba zwyrodnieniowa stawów, zapalenie stawów i indukowana sterydami martwica kości.
W wynikach długoterminowych obserwacji zastosowania świeżych przeszczepów chrzęstno-kostnych w uszkodzeniach pourazowych, przeżywalność wynosiła odpowiednio 95%, 80% i 65%, po 5,10 i 15 latach po operacji. Badania wykazały, że alloprzeszczep chrzęstno-kostny miał pozytywne rezultaty u 85%, a zakończył się niepowodzeniem u 15% pacjentów, po 7,5 roku po operacji. Jeśli chodzi o czynniki wpływające na alloprzeszczep chrzęstno-kostny, niektórzy wiążą niepowodzenia z dwubiegunowymi defektami piszczeli i kości udowej, nieprawidłowym ustawieniem kolan oraz korzystaniem ze świadczeń ubezpieczenia pracowniczego. Chrzęstno-kostny alloprzeszczep może przynosić korzyści w utrzymywaniu pozytywnych wyników dla rozległych chrzęstnych lub chrzęstno-kostnych uszkodzeń, które nie mogą być leczone przy pomocy OAT lub ACI.
Ryc. 9 Alloprzeszczep
c) implantacja rusztowania tkankowego (skafoldu),
Skafold jest trójwymiarowym podkładem włókninowym umieszczanym w miejscu ubytku chrząstki stawowej. W naszej placówce medycznej stosujemy najnowszej generacji podkład Hyalofast składający się włókien kwasu hialuronowego, będącego kluczowym komponentem ludzkiej chrząstki.
Skafold może być połączony z różnymi metodami regeneracji chrząstki stawowej – metodą mikrozłamań lub metodą z wykorzystaniem koncentratu aspiratu szpiku kostnego (BMAC). W przypadku zastosowania podkładu hialuronowego w metodzie mikrozłamań, podkład ten tworzy chondroprotekcyjną powłokę zwiększającą przeżywalność komórek macierzystych i tym samym stwarza optymalne środowisko do formacji adhezyjnego skrzepu krwi wypełniającego ubytek chrzęstny. Istotnie zwiększa to rezultaty kliniczne i umożliwia pacjentom szybszy powrót do aktywności.
W przypadku zastosowania koncentratu aspiratu szpiku kostnego, podłoże Hyalofast wspomaga adhezję mezenchymalnych komórek macierzystych (MSC), ich proliferację i zróżnicowanie. Struktura podkładu wspiera trójwymiarową organizację odbudowującej się tkanki chrzęstnej wypełniającej ubytek, dzięki czemu sprzyja dobrej integracji wszczepu.
d) "Spray" na chrząstkę
W naszej placówce medycznej stosujemy również metodę regeneracji chrząstki szklistej opartej na spreju, który stanowi mieszaninę komórek macierzystych uzyskanych ze szpiku kostnego pacjenta oraz fibryny pochodzącej z krwi pacjenta. Spray chrzęstny w szybkim tempie integruje się w miejscu ubytku, dzięki czemu możliwe jest jeszcze szybsze rozpoczęcie rehabilitacji, która stanowi niezmiernie istotny element efektywnego procesu leczenia.
Uszkodzenia chrząstki są trudne w leczeniu. Rozmaite badania opisują wprowadzanie nowych metod rekonstrukcji oraz ich rezultaty kliniczne. Jednakże nie ma jednomyślności odnośnie tego, która metoda przeważa nad innymi. Do czynników, które trzeba brać pod uwagę przy wyborze chirurgicznej metody leczenia ogniskowych uszkodzeń chrząstki, należą: przyczyna uszkodzenia, współistniejące defekty, wiek i poziom aktywności pacjenta, ustawienie kolan, rozmiar uszkodzenia, koszty i ryzyko operacji.
Zmiany degeneracyjne nie mogą być prawidłowo leczone chirurgiczną rekonstrukcją chrząstki stawowej.
U pacjentów o niskiej aktywności, artroskopowy zabieg oczyszczania jest jedyną możliwością leczenia uszkodzeń kolana, niezależnie od wielkości.
Współistniejące defekty objętego schorzeniem kolana lub nieprawidłowości w ustawieniu powinny zostać wyleczone przed chirurgiczną rekonstrukcję chrząstki stawowej.
Dla zmian o wielkości 1-2 cm2, zabieg metodą mikrozłamań lub artroskopowe oczyszczanie mogą być leczeniem z wyboru u pacjentów o niskiej aktywności, podczas gdy OAT jest skuteczne u osób o dużej aktywności.
ACI może być rozwiązaniem dla pacjentów o wysokiej aktywności, którzy nie mogą znaleźć dawcy, bądź gdy zabiegi mikrozłamań lub OAT zakończyły się niepowodzeniem.
Dla zmian większych niż 4cm2, ACI jest preferowaną metodą, a dodatkowy przeszczep kości powinien zostać przeprowadzony w przypadku stwierdzenia utraty tkanki kostnej.
Uszkodzenia chrzęstno-kostne większe niż 10cm2, miejscowa martwica kości i pourazowe uszkodzenia chrząstki są leczone metodą alloprzeszczepu chrzęstno-kostnego.
Chrząstka stawowa nie odpowiada zbyt dobrze na leczenie. Uszkodzenie chrząstki stawowej stopniowo prowadzi do choroby zwyrodnieniowej stawów. Celem obecnych metod leczenia uszkodzeń chrząstki jest zapobieganie procesowi degeneracyjnemu, poprzez odtwarzanie tkanki podobnej do chrząstki szklistej. Spośród różnych technik, mających pomóc w osiągnięciu tego celu, optymalny wybór metody leczenia powinien być oparty na zrozumieniu podstaw teoretycznych, wskazań, procedury chirurgicznej, rehabilitacji, powikłań i klinicznego przebiegu leczenia.
Często wyszukiwane tematy:







 Jan Paradowski - jest właścicielem Paradowski Medical Group sp. z o.o., która posiada placówkę medyczną Sport Med w Krakowie przy ulicy Miłkowskiego 11A i przy ul. Wrocławskiej 33. Bogate doświadczenie zagraniczne pozwoliło mu na stosowanie nowoczesnych metod, dostępnych w najlepszych światowych ośrodkach. Jako lekarz wypracował własne schematy leczenia terapiami biologicznymi, jak terapia PRP, czy
Jan Paradowski - jest właścicielem Paradowski Medical Group sp. z o.o., która posiada placówkę medyczną Sport Med w Krakowie przy ulicy Miłkowskiego 11A i przy ul. Wrocławskiej 33. Bogate doświadczenie zagraniczne pozwoliło mu na stosowanie nowoczesnych metod, dostępnych w najlepszych światowych ośrodkach. Jako lekarz wypracował własne schematy leczenia terapiami biologicznymi, jak terapia PRP, czy